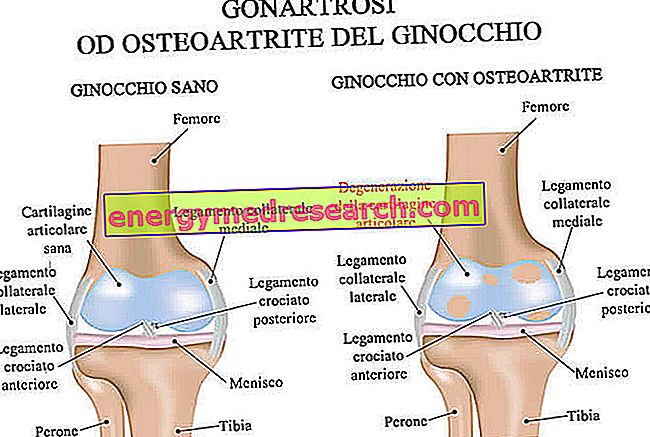
Hva er Sustiva?
Sustiva er et stoff som inneholder aktiv substans efavirenz. Det er tilgjengelig i kapsler (gul og hvit: 50 mg, hvit: 100 mg, gul: 200 mg), i gule kapselformede tabletter (600 mg) og i en oral oppløsning 30 mg / ml).
Hva brukes Sustiva til?
Sustiva er et antiviralt stoff, angitt i kombinasjon med andre antivirale legemidler for å behandle voksne og barn minst 3 år med humant type immunsviktvirus. Dosen av Sustiva bør reduseres for pasienter som tar vorikonazol (til behandling av soppinfeksjoner). Pasienter som tar rifampicin (et antibiotika) må kanskje ta en høyere dose Sustiva.
For mer informasjon, se oppsummering av produktegenskaper (også inkludert i EPAR).
Hvordan jobber Sustiva?
Sustiva inneholder den aktive ingrediensen efavirenz, en ikke-nukleosid revers transkriptaseinhibitor (NNRTI). Det blokkerer aktiviteten av revers transkriptase, et enzym produsert av HIV-viruset som gjør at det kan infisere celler i kroppen og produsere flere virus. Ved å blokkere dette enzymet, reduserer Sustiva, tatt i kombinasjon med andre antivirale legemidler, mengden HIV i blodet, og holder den på et lavt nivå. Sustiva helbreder ikke HIV-infeksjon eller AIDS, men det kan
forsinke skaden på immunsystemet og utviklingen av infeksjoner og sykdommer assosiert med aids.
Hvordan har Sustiva blitt studert?
Sustiva har blitt undersøkt i tre hovedstudier med mer enn 1 100 voksne:
- Den første studien sammenlignet Sustiva i kombinasjon med lamivudin og zidovudin eller indinavir (andre antivirale legemidler) med kombinasjonen av indinavir, lamivudin og zidovudin;
- Den andre studien sammenlignet Sustiva i kombinasjon med nelfinavir og to andre antivirale legemidler med samme kombinasjon uten Sustiva;
- Den tredje studien sammenlignet tillegget av Sustiva eller placebo (en dummybehandling) til et behandlingsregime basert på antivirale legemidler, inkludert indinavir og to andre antivirale legemidler, hos pasienter som tidligere ble behandlet for HIV-infeksjon.
Sustiva har også blitt studert hos 57 barn i alderen 3 til 16 år, i kombinasjon med nelfinavir og andre antivirale legemidler.
I alle de ovennevnte studiene var det viktigste effektmålet antall pasienter med HIV-1-nivåer som ikke var merkbare i blodet (virusbelastning) etter 24 eller 48 ukers behandling.
Hvilken fordel har Sustiva vist i studiene?
Studier har vist at terapeutiske kombinasjoner som involverer bruk av Sustiva, er like effektive som komparatormedisinene:
- Den første studien viste at 48 uker senere viste 67% av de voksne som ble behandlet med Sustiva i kombinasjon med zidovudin og lamivudin en virusbelastning på mindre enn 400 kopier / ml sammenlignet med 54% av pasientene behandlet med Sustiva og indinavir, og 45% av de som ble behandlet med indinavir, lamivudin og zidovudin;
- i den andre studien ga Sustiva i kombinasjon med nelfinavir bedre resultater enn kombinasjonen uten Sustiva med henholdsvis 70% og 30% av pasientene med viral belastning mindre enn 500 kopier / ml etter 48 ukers behandling;
- Resultatene fra den tredje studien viser at etter 24 uker hadde en høyere prosentandel av pasientene behandlet med Sustiva virusbelastninger under 400 kopier / ml sammenlignet med pasienter behandlet med placebo.
Lignende resultater ble funnet i studien på barn.
Hva er risikoen forbundet med Sustiva?
De vanligste bivirkningene som ses med Sustiva (sett hos flere enn 1 av 10 pasienter) er hudutslett. Sustiva kan også involvere symptomer på nervesystemet som svimmelhet, søvnløshet, døsighet, problemer med å konsentrere seg og endre drømaktivitet og psykiatriske lidelser, inkludert alvorlig depresjon, selvmordstanker, selvmordsforsøk og aggressiv atferd, spesielt hos pasienter med en historie med psykisk sykdom. Å ta Sustiva sammen med mat kan øke hyppigheten av bivirkninger. For fullstendig liste over alle bivirkninger som er rapportert for Sustiva, se pakningsvedlegget.
Sustiva skal ikke brukes til personer som kan være overfølsomme (allergiske) mot efavirenz eller noen av de andre stoffene. Det må ikke brukes til pasienter med alvorlig nedsatt leverfunksjon eller behandles med noen av følgende legemidler:
- astemizol, terfenadin (vanligvis brukt til å behandle allergi symptomer - disse medisinene kan kjøpes uten resept);
- dihydroergotamin, ergotamin, ergonovin, metylergonovin (brukt til behandling av migrene);
- midazolam, triazolam (brukt til behandling av angst eller søvnforstyrrelser);
- pimozid (til behandling av psykiske lidelser);
- cisaprid (til behandling av visse magesykdommer);
- bepridil (for behandling av angina);
- St. John's wort (et urtepreparat brukt til behandling av depresjon).
Til slutt skal forsiktighet brukes i bruk av Sustiva hos pasienter som samtidig tar andre medisiner. For ytterligere detaljer, se pakningsvedlegget.
Som med andre anti-hiv-legemidler kan pasienter som får Sustiva være utsatt for lipodystrofi (forandringer i fordelingen av kroppsfett), osteonekrose (død av beinvev) eller immunreaktiveringssyndrom (symptomer på infeksjoner forårsaket av reaktivering av immunsystemet ). Pasienter med leverproblemer (inkludert hepatitt B eller C) kan ha stor risiko for å utvikle leverskade hvis de blir behandlet med Sustiva.
Hvorfor har Sustiva blitt godkjent?
Utvalget for legemidler til mennesker (CHMP) har fastslått at fordelene med Sustiva oppveier risikoen ved antiviral behandling av voksne, ungdom og barn 3 år eller eldre med HIV i kombinasjon med andre antivirale legemidler. Utvalget bemerket at Sustiva ikke er blitt studert tilstrekkelig hos pasienter på et avansert stadium av sykdommen (med CD4-celletall mindre enn 50 celler / mm3) eller hvor behandling med proteasehemmere (en annen type antiviral medisin) er enten avsluttet uten suksess. Utvalget bemerket også at den foreliggende informasjonen ikke er tilstrekkelig til å evaluere effekten av terapier basert på bruk av proteasehemmere som brukes etter sviktet av Sustiva-behandling, selv om det ikke foreligger noe bevis for at hos disse pasientene proteasehemmere er ikke effektive. Utvalget anbefalte tildeling av markedsføringstillatelse til Sustiva.
Mer informasjon om Sustiva
Den 28. mai 1999 utstedte EU-kommisjonen en markedsføringstillatelse for Sustiva, gyldig i hele EU. Indehaveren av markedsføringstillatelsen er Bristol-Myers Squibb Pharma EEIG. Markedsføringstillatelsen ble fornyet 28. mai 2004 og 28. mai 2009.
For hele EPAR of SUSTIVA, klikk her.
Siste oppdatering av denne sammendraget: 05-2009.