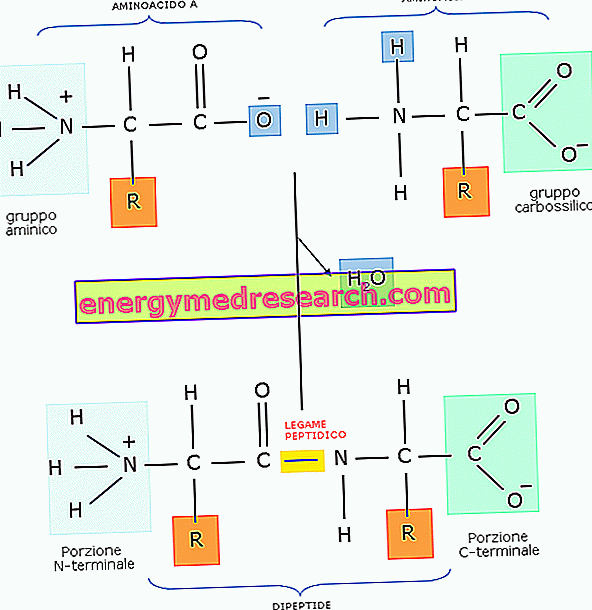
Peptidbindingen er en kovalent binding som er etablert mellom to molekyler, når karboksylgruppen av en reagerer med aminogruppen i den andre gjennom en kondensasjonsreaksjon (eller dehydrering som fører til eliminering av en vannmolekyl ).
Vanligvis dannes peptidbindingen mellom to aminosyrer, som stammer fra et dipeptid.
Siden et dipeptid i molekylet dessuten omfatter en aminogruppe og en karboksylsyre, kan den danne en peptidbinding med en tredje aminosyre som oppstår et tripeptid og så videre. Når antall aminosyrer er relativt små kalles det oligopeptid, mens om antall aminosyrer øker kalles det polypeptid eller protein.
I virkeligheten, til tross for figuren, er peptidbindingen ikke enkel, men presenterer for 60% en enkeltbindingsteknologi og for 40% en dobbeltbindingskarakter.
I levende organismer katalyseres dannelsen av peptidbindingen av et enzym - kalt peptidyltransferase - tilstede i hovedunderenheten av ribosomer.
Selv proteiner som er introdusert i dietten, består av kjeder av aminosyrer forbundet med peptidbindinger. Under fordøyelsen brytes disse bindingene av spesielle enzymer (peptidaser) tilstede i mage- og bukspyttkjertelsjuice. De enkelte aminosyrene, som en gang er absorbert av tarmen, passerer fra blodet og tas opp av cellene - fremfor alt av leveren - som forener dem gjennom nye peptidbindinger for å danne proteiner de trenger (ikke bare strukturelle men også hormonelle, enzymatiske osv. .). I naturen er det faktisk et stort antall proteiner, med forskjellige fysisk-kjemiske egenskaper, som kommer fra de forskjellige egenskapene til de 20 vanlige aminosyrene og fra hvordan disse kombineres i polypeptidkjeden. Det er nok å si at et protein på 100 aminosyrer, derfor relativt lite, kan bestå av 20100 = 1, 27 x 10130 mulige polypeptidkjeder. Instruksjonene for å bygge den korrekte aminosyrekjeden er innelukket i individets genom.



