proteiner
Proteiner er polymere molekyler sammensatt av mer enn 100 aminosyrer bundet av peptidbindinger (kortere aminosyrekjeder kalles polypeptider eller peptider); strukturen av proteiner kan være mer eller mindre lang, foldet tilbake på seg selv og festet til andre molekyler (faktorer som bestemmer dens kompleksitet og karakteriserer dens biologiske funksjon). Disse strukturene kan klassifiseres i: primærstruktur, sekundær struktur (a-helix og p-brikke), tertiær struktur og kvaternær struktur.
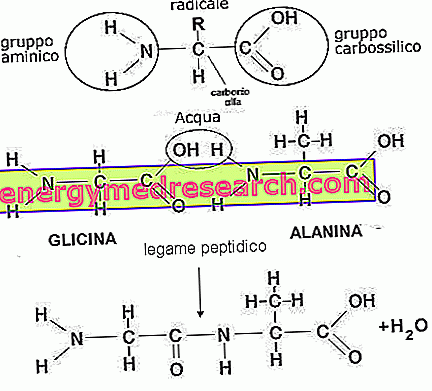

Proteinfunksjoner
I naturen utfører proteiner mange funksjoner, og den mest kjente er utvilsomt den strukturelle; bare tenk at hver vævsmatrise av organismen vår er basert på et skjelett eller en polymer mosaikk dannet av peptider (f.eks. muskelfibre, benmatrise, bindevev og, fra et bestemt synspunkt, til og med blod).
Ikke mindre viktig er funksjonen av bioregulering og kjemisk / hormonell mekling, faktisk er proteiner de grunnleggende bestanddelene i begge enzymer og mange hormoner.
I blod spiller proteiner også en svært viktig transportfunksjon; Dette gjelder for hemoglobin (oksygentransport), transferrin (jerntransport), albumin (transport av lipidmolekyler), etc.
Fortsatt innenfor sirkulasjonsstrømmen, viser proteiner nyttig som et immunforsvar; de utgjør ANTICORPI, essensielle molekyler produsert av lymfocytter som er nyttige i responsen til organismen mot patogener.
Endelig kan proteiner - men mer nøyaktig aminosyrer - brukes til energiforbruk ved hjelp av hepatisk neoglukogenese og gi 4 kilokalorier (kcal) per gram. Det er en ganske komplisert prosess som gjennom transaminering og deaminering gjør at kroppen kan produsere glukose under hypoglykemiske forhold (muligens indusert ved fasting, spesielt intens og / eller langvarig muskulær innsats, patologiske forhold eller uønskede kliniske forhold, etc.). Noen neoglukogene aminosyrer kan også være ketogene, slik at deres konvertering bestemmer frigjørelsen av syremolekyler kalt ketonlegemer.
NB. Energifunksjonen til proteiner bør være marginell og underordnet den for sukker og fett.
Aminosyrer
Aminosyrer er kvaternære molekyler som består av karbon, hydrogen, oksygen og nitrogen. Mer enn 500 typer er kjent, og deres kombinasjon skiller utallige former for peptider. De vanlige, L-aminosyrene, er 20: alanin, arginin, asparagin, asparaginsyre, cystein, glutaminsyre, glutamin, glycin, histidin, isoleucin, leucin, lysin, metionin, fenylalanin, prolin, serin, treonin, tryptofan, tyrosin og valine . Fra sistnevnte metabolisme er det mulig å oppnå et bredt spekter av ikke-vanlige eller sporadiske aminosyrer som hovedsakelig utgjør hormoner, enzymer eller mellomproduktmolekyler (karnitin, homocystein, kreatin, taurin, etc.).
Blant de vanlige aminosyrene kan noen ikke syntetiseres av organismen og kalles ESSENTIAL; for den voksne mannen er det 9: fenylalanin, leucin, isoleucin, lysin, metionin, treonin, tryptofan og valin . Hos barn er det 11 i det hele tatt; til de forrige er lagt til: histidin og arginin .
Andre klassifiseringer av aminosyrer er: Basert på polariteten til deres sidekjeder (nøytral apolær, polar nøytral, syrekostnader, grunnleggende kostnader) eller basert på typen av radikale gruppe (hydrofob, hydrofil, syre, basisk, aromatisk).
De forgrenede aminosyrene
Blant de essensielle er det også tre forgrenede aminosyrer (BCAAs), henholdsvis leucin, isoleucin og valin ; Egenheten som skiller de forgrenede aminosyrene fra andre, representeres av en annen metabolsk vei for energiproduksjon.
Som allerede forklart, etter transaminasjonsdeaminering kan de fleste aminosyrer være bestemt for neoglukogenese og inn i Krebs syklusen i form av oksalacetat eller pyruvat . Til slutt, hvis det var noen reelle behov, ville noen av aminosyrene tilstede i sirkulasjonsstrømmen komme inn i leveren hepatocytter og gå ut som glukose; Dette er ikke tilfellet for forgrenede aminosyrer. Sammenliknet med de andre er BCAAene DIREKTE anvendelige molekyler fra musklene, og denne særegenheten gjør dem mye mer effektive i direkte energiproduksjon og i konvertering for rekonstitusjon av glykogenreserver. Det sier seg selv at hvis organismen er tilstrekkelig matet, representerer katabolismen av forgrenede aminosyrer en nesten irrelevant neoglukogenetisk del; Glukose forblir ALLTID den primære energikilden, derfor under betingelser med glykemi og tilstrekkelig glykogenreserver, selv under en vanlig atletisk ytelse, er det ingen grunn til å frykte at muskelen trenger et overskudd av forgrenede aminosyrer.