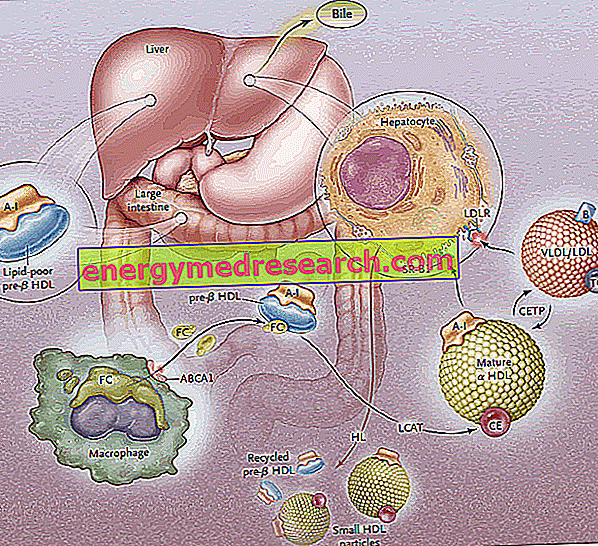
Omvendt kolesteroltransport (RCT) er prosessen ved hvilken kolesterol fjernes fra perifert vev, gjennom inkorporering i HDL lipoproteiner og påfølgende transport til leveren for galdeutskillelse.
Perifere celler, som alle ikke-tarm- eller leverceller, kan ikke nedbryte overskytende kolesterol; Derfor er tilstedeværelsen av en mekanisme dedikert til fjerning av kolesterol fra cellene avgjørende for vedlikehold av cellulær homeostase. Denne mekanismen, rettet mot hepatisk gjenoppretting av overflødig perifer kolesterol, kalles "revers kolesteroltransport" (RCT: revers kolesteroltransport ).
La oss undersøke prosessen i detalj.
Biosyntese av HDL lipoproteiner passerer gjennom syntesen og innledningen av hovedproteinkomponentene (apoproteiner), etterfulgt av ekstracellulær oppkjøpet av lipider (fosfolipider og kolesterol) som fører til montering og generering av modne HDL-partikler.
Den første fasen av omvendt kolesteroltransport består i dannelse, gjennom tarmen og leveren, av discoide forløpere av HDL, som på deres overflate utsetter apoproteiner (hovedsakelig ApoA-I); Forløpermolekyler av HDL kalt pre-B-HDL frigjøres således, som innbefatter svært små mengder kolesterol og lipider, spesielt fosfolipider. Tilstedeværelsen av disse forløpermolekylene ved det perifere nivå fremmer overføringen av overskudd av gratis kolesterol (FC) - rømming fra perifere vevsceller - til apo AI, gjennom inngrep av en membrantransportør kalt ATP-bindende kassett A1 (ABCA1 ). Denne transportøren befinner seg på celleoverflaten og i Golgi-membranene, og kan transportere lipidene fra Golgi-apparatet til cellemembranen, noe som letter deres utstrømning. På dette tidspunktet, så snart det frie kolesterolet kommer inn i de native HDLene, går et plasmatisk enzym av hepatisk opprinnelse inn, kalt plasmalecitin-kolesterol acyltransferase eller mer enkelt LCAT; dette enzymet konverterer det frie kolesterolet innlemmet i pre-B-HDL i kolesterolestere, og transformerer pre-B-HDL til deres modne a-HDL-form; i praksis omdanner kontinuerlig opphopning av kolesterol i lipoproteinkjernen discoid HDL til sfæriske og klumpete partikler, som ytterligere kan anskaffe apoproteiner fra lipoproteinpartiklene rike på triglyserider og smelt sammen. I hele prosessen spiller apolipoprotein AI en nøkkelrolle som stimulerer både aktiviteten til ABCA1-transportøren og LCATs aktivitet. Siden ApoAI er det mest representert apolipoproteinet i HDL, er plasmakonsentrasjonen direkte relatert til HDL-kolesterolnivå.
VENNLIGST MERK: Foresteringsprosessen er grunnleggende for å forhindre omfordeling av kolesterol fra HDL til plasmamembranen; denne mekanismen utnytter fettsyren i posisjon to tilstede i fosfatidylkolinmolekylene.
Den LCAT-medierte forestringsprosessen forvandler deretter pre-B-HDL-molekylene til deres "modne" a-HDL sfæriske form. Disse lipoproteiner blir deretter transportert til leveren, hvor de frigjør kolesterol, ifølge to forskjellige ruter.
I et første tilfelle gir HDL rik på esterifisert kolesterol dette lipidet til lipoproteiner som er rike på triglyserider (veldig lavt tetthet og lavdensitetslipoproteiner), deretter oppfanget av leveren gjennom spesifikke reseptorer (LDL-R) og fjernet fra sirkulasjonen. Målet er å formidle perifert kolesterol til leveren via LDL-reseptorsystemet, og deretter "utslipp" HDL fra overflødig kolesterol til perifert nivå, slik at de blir tilgjengelige igjen for å motta det fra vevet; Tømmer seg selv av kolesterol, HDLer aksepterer triglyserider i bytte, og dette skjer takket være cholesterol ester transfer protein (CETP). Oppgaven av dette proteinet er derfor å fremme omfordeling og likevekt av kolesterolestere og triglyserider mellom HDL, LDL, IDL, VLDL, chylomicron og chylomicron lipoproteiner, noe som fører som et nettoresultat til en anrikning i HDL-triglyserider, til skade for kolesterolestere og en reduksjon i HDL-størrelse.
Den andre vei involverer hepatiske SR-B1-reseptorer for HDL rik på forestret kolesterol, i fravær av samtidig nedbrytning av proteindelen av HDL, som deretter resirkuleres. I praksis kan dette enzymet tømme HDLene fra innholdet og regenerere nye pre-B-HDLer. En del av HDL og ApoA-I er imidlertid internalisert og nedbrytet på lysosomalt nivå, både i lever- og nyreceller. Opptaket mediert av SR-B1 blir gjort mer effektivt ved aktiviteten av den hepatiske lipasen, som er i stand til å remodelere HDL ved hydrolysering av overflatefosfolipidene og tillate strømmen av forestret kolesterol fra lipoproteinkjernen mot plasmamembranen (det er hypoteset mellom For det andre, at ApoE også er involvert i selektiv opptak, da mus som mangler ApoE-genet, viser en reduksjon i effekten av denne bane). SR-BI uttrykkes hovedsakelig i leveren, binyrene og eggstokken.