morfologi
På makroskopisk nivå kan en variabel grad av kortikal atrofi (reduksjon av vev eller organmasse) observeres i Alzheimers sykdom, kjennetegnet ved forstørrelse av parietalfurene, mer accentuert i frontale, temporale og parietale lober. Denne atrofi kompenseres av en utvidelse av ventrikulære hulrom sekundært til tap av parenchyma (figur 1). Spesielt i de avanserte stadier av sykdommen, strukturer av medial temporal lobe, inkludert hippocampus, entorhinal cortex og amygdala, atrofi alvorlig, gitt deres engasjement startende fra de tidlige stadier av patologien.
Videre presenterer Alzheimers sykdom også mikroskopiske endringer, kjent som ekstracellulære senile plaques og intracellulære neurofibrillære klynger, som representerer grunnlaget for histologisk diagnose. Med sykdomsprogresjonen er det derfor et alvorlig nevronetap ledsaget av gliose (begrenset eller diffus proliferasjon, reaktiv i naturen, av neuroglia-celler, det vil si celler som utgjør den støttende stroma av nervesvev) i de samme regionene hvor tilstedeværelsen av neurofibrillære plaketter og klynger er større.
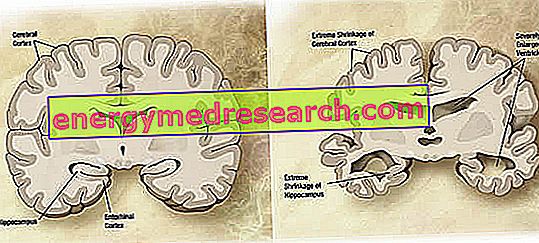
Figur 1. Koronal seksjon av hjerne: forskjeller mellom normal hjerne og hjerne påvirket av AD (wikipedia bildekilde).
patogenesen
Alzheimers sykdom er preget av to typiske lesjoner: Den ekstracellulære akkumulering av senile plaques består hovedsakelig av β-amyloidpeptid (Aβ) og intraneuronale nevrofibrillære klynger, dannet av hyperfosforylert tau-protein.
- Senile plakk kan finnes på nivået av hjernen områder som hippocampus, amygdala og neocortex.
Ap-peptid stammer fra en proteolytisk kutt av amyloidproteinforløperen (APP), ved p-sekretase. Denne kutt genererer et terminal karboksyfragment på 99 rester (CTF eller C99) som deretter kuttes av p-sekretasen for å generere Ap-fragmenter med forskjellige lengder. Det er kjent at den mest omfattende arten av Aβ er Aβ40-fragmentet. Et annet kjent fragment dannet fra proteolytisk kutt, mindre rikelig enn Ap40, er A42, mer tilbøyelig til å danne amyloidfibriller, som akkumuleres som en Ap-art i hjernen til et individ med Alzheimers sykdom.
- En annen komponent som er tilstede i Alzheimers sykdom, er representert av neurofibrillære klynger som består av bunter av filamenter tilstede i cytoplasma av nevroner. Neurofibrillære klynger er uoppløselige og ser ut til å være resistente mot proteolyseprosesser in vivo, og forblir dermed tilstede i vevseksjoner, selv i lang tid etter nevronaldød. Ved å observere strukturen består fibrillerklyngene av doble helixfilamenter og lineære filamenter med lignende sammensetning. Analysere sammensetningen, er de dobbelte helixstrenger hovedsakelig laget av hyperfosforylert tau-protein. Tau er et aksonalt protein assosiert med mikrotubuli som letter samlingen.
Andre viktige nevropatologiske endringer som er tilstede i Alzheimers sykdom inkluderer mitokondriell dysfunksjon, oksidativ nevronskader, synaptisk tap og aksonal degenerasjon.
Neurokjemiske aspekter
Som allerede forklart, representerer Ap-peptid, som kommer fra proteolytisk kutt av APP-forløperen, en nevrotoksisk komponent av Alzheimers sykdom . Spesielt er det blitt hypotetisert at Aβ kan være viktig for normale hjernefunksjoner, og hvis den overvinter bestemte konsentrasjoner, kan det bli nevrotoksisk. I tillegg kan både aggregatene og de forskjellige isoformene til Aβ ha en annen biologisk, fysiologisk eller patologisk rolle, bestemme og delta i de påfølgende stadier av sykdommen. Det har blitt observert at Aβ virker som en neuromodulator, som påvirker frigivelsen av noen nevrotransmittere i fravær av åpenbare tegn på nevrotoksisitet.
For eksempel kan den neuromodulatoriske rollen av Aβ i en fysiologisk sammenheng ha en viktig betydning for den korrekte balansen mellom nevrotransmittersystemet. Det er velkjent at dette systemet består av nevrotransmittere, stoffer som formidler informasjon mellom cellene som utgjør nervesystemet, nevronene, gjennom synaptisk overføring.
I patologiske forhold, derimot, kunne Aβ-mediert synaptisk overføring være relatert til endring av nevrotransmisjon før nevrodegenerative hendelser. Som et resultat av disse endringene kan det oppstå tidlige kognitive og ikke-kognitive forstyrrelser, basert på de berørte nevrotransmittersystemene og de forskjellige hjerneområdene som er involvert.
Endringene i nevrotransmittersystemene og signaltransduksjonsmekanismen i hjernen til individer som lider av Alzheimers sykdom er svært komplekse. Et av systemene som synes å bli endret, gjelder det kolinergiske signalsystemet, som involverer neurotransmitteren acetylkolin. Faktisk har det vist seg at individer som lider av Alzheimers sykdom, viser redusert kolinergtransmisjon på nivået av cortex og hippocampus, viktige hjerneområder dedikert til fenomen som læring og minne. I tillegg til dette nevrotransmittersystemet har endringer i noradrenerge, serotonergiske, samt glutamat- og GABA-systemer blitt observert i Alzheimers sykdom.



