Hva er Cerdelga - eliglustat brukt til?
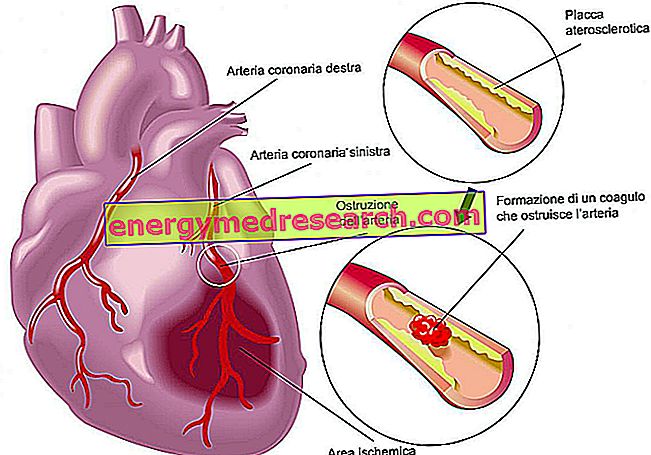
Cerdelga er et middel som er indikert for langvarig behandling av voksne pasienter med Gauchers sykdom av type 1. Gauchersykdom er en sjelden arvelig sykdom hvor det er mangel på et enzym som kalles glukokerebrosidase (også kalt beta-glukosidasyre), som vanligvis metaboliserer et fett som kalles glukosylseramid (eller glukocerebroside). I fravær av enzymet, legges fett i kroppen, vanligvis i leveren, milten og bein. Dette resulterer i de typiske symptomene på sykdommen: anemi (lavt antall røde blodlegemer), tretthet, tendens til økymose og blødning, utvidelse av milt og lever, bein smerte og brudd. Cerdelga brukes til pasienter med Gaucher sykdom av type 1, som er skjemaet som vanligvis påvirker leveren, milten og beinene. Det brukes i emner som metaboliserer det ved normal hastighet (dvs. i de såkalte "intermediære metabolisatorene" eller "omfattende") eller ved sakte hastighet ("sakte metabolisatorer"). Fordi antall pasienter med Gaucher-sykdom er lav, anses sykdommen som "sjelden" og Cerdelga ble utpekt som "sjeldne legemidler" (et legemiddel som brukes i sjeldne sykdommer) 4. desember 2007. Cerdelga inneholder den aktive ingrediens eliglustat.
Hvordan brukes Cerdelga - eliglustat?
Cerdelga er tilgjengelig som kapsler (84 mg) som skal tas i munnen. Legemidlet kan kun oppnås på resept og behandling skal startes og etterfølges av en lege med erfaring i behandling av Gauchers sykdom. Før behandling med Cerdelga påbegynnes, er det nødvendig å utføre en test for å fastslå hastigheten av metabolisering av legemidlet i pasientens kropp (dvs. å avgjøre om det er et spørsmål om langsomme, mellomliggende eller omfattende metaboliserende stoffer). Legemidlet bør ikke administreres til pasienter som metaboliserer det med en meget høy hastighet (såkalte "ultra-rask metaboliserende midler") eller til personer som ikke har mulighet for å metabolisere stoffet, eller hvor metabolismen ikke har blitt bestemt med en spesiell test. Den anbefalte dosen av Cerdelga er en kapsel to ganger daglig hos pasienter med normal metaboliserende aktivitet (intermediære eller omfattende metaboliserende midler). Hos pasienter hvis kropp metaboliserer medisinen langsomt (treg metabolisere), er anbefalt dose en kapsel en gang daglig. For mer informasjon, se pakningsvedlegget.
Hvordan fungerer Cerdelga - eliglustat?
Det aktive stoffet i Cerdelga, eliglustat, virker ved å blokkere virkningen av et enzym involvert i produksjonen av glukosylceramid. Siden opphopningen av dette fettstoffer i organer som milten, leveren og beinene er ansvarlig for symptomene på type 1 Gaucher-sykdom, reduserer produksjonen å begrense opphopningen i slike organer, noe som derfor fungerer bedre.
Hvilken fordel har Cerdelga - eliglustat vist under studiene?
Cerdelga har vist seg å være effektiv i behandlingen av Gaucher sykdom i to hovedstudier. 40 pasienter med tidligere ubehandlet type 1 Gaucher sykdom deltok i den første studien, som hovedsakelig undersøkte reduksjonen i miltstørrelsen. Emner behandlet med eliglustat viste en gjennomsnittlig reduksjon i miltstørrelsen med 28% sammenlignet med 2% økning observert hos pasienter behandlet med placebo (en dummybehandling) ni måneder etter behandlingen. Pasienter behandlet med Cerdelga har også vist en forbedring av andre tegn på sykdommen, inkludert reduksjon i leverens størrelse og økning i hemoglobinnivåer (proteinet i røde blodlegemer som bærer oksygen i kroppen). Effekten av Cerdelga ble også demonstrert i en annen studie som involverte 160 pasienter med Gaucher sykdom av type 1, som tidligere var behandlet med en fraværsbehandling av enzymet og hos hvem symptomene på sykdommen var under kontroll. Noen pasienter ble behandlet med Cerdelga, mens andre ble behandlet med enzymutskiftningsterapi. Fra denne studien ble det funnet at sykdommen etter et års behandling forblir stabil hos 85% av pasientene behandlet med Cerdelga sammenlignet med 94% av pasientene som fortsatte med enzymutskiftningsterapi.
Hva er risikoen forbundet med Cerdelga - eliglustat?
Den vanligste bivirkningen av Cerdelga (som kan påvirke mer enn 1 av 10 personer) er diaré, noe som rammer ca 6 av 100 pasienter. De fleste bivirkningene er milde og forbigående. For fullstendig liste over alle bivirkninger som er rapportert for Cerdelga, se pakningsvedlegget. Cerdelga bør ikke tas i kombinasjon med visse legemidler som kan forstyrre kroppens evne til å nedbryte det, da denne forstyrrelsen kan påvirke nivåene av Cerdelga i blodet. For fullstendig liste over begrensninger, se pakningsvedlegget.
Hvorfor har Cerdelga-eliglustat blitt godkjent?
Byråets komité for legemidler til mennesker (CHMP) bestemte at Cerdelga fordeler er større enn risikoen, og anbefalte at den godkjennes for bruk i EU. Cerdelga har vist seg å være effektivt for å forbedre symptomene på sykdommen hos et flertall av tidligere ubehandlede type 1 Gaucher-sykdomspatienter, samt å holde sykdommen stabil i de fleste pasienter som tidligere har blitt behandlet med enzymutskiftningsterapi. Imidlertid reagerte en minoritet av pasientene (ca. 15%) som byttet fra en enzymutskiftningsterapi til Cerdelga ikke optimalt etter en års behandling. For disse pasientene bør andre behandlingsalternativer vurderes. Sykdomsprogresjon bør overvåkes periodisk hos alle pasienter som bytter fra en enzymutskiftningsterapi til Cerdelga. Med hensyn til sikkerhet, selv om bivirkningene var for det meste milde og forbigående, anbefalte CHMP videre å undersøke medisinens langsiktige sikkerhet.
Hvilke tiltak blir det tatt for å sikre en sikker og effektiv bruk av Cerdelga - eliglustat?
En risikostyringsplan er utviklet for å sikre at Cerdelga brukes så trygt som mulig. Basert på denne planen er sikkerhetsinformasjon inkludert i resuméet av produktegenskaper og pakningsvedlegget for Cerdelga, inkludert de nødvendige forholdsregler som skal følges av helsepersonell og pasienter. I tillegg vil selskapet som markedsfører Cerdelga, gi legene og pasientene informasjonsmateriale for å sikre at bare personer med type 1 Gaucher sykdom blir behandlet med Cerdelga, og at legemidlet ikke brukes i kombinasjon med andre legemidler som kan endre den blodnivåer. Alle pasienter som vil bli foreskrevet Cerdelga vil motta et varselkort. Selskapet vil også beholde et register over pasienter behandlet med Cerdelga for å vurdere medisinens langsiktige sikkerhet. Ytterligere informasjon er tilgjengelig i sammendraget av risikostyringsplanen.
Mer informasjon om Cerdelga - eliglustat
Den 19. januar 2015 utstedte EU-kommisjonen en markedsføringstillatelse for Cerdelga, gyldig over hele EU. For mer informasjon om behandling med Cerdelga, les pakningsvedlegget (også en del av EPAR) eller kontakt lege eller apotek. Sammendraget av uttalelsen fra komiteen for sjeldne legemidler knyttet til Cerdelga er tilgjengelig på agenturets nettsted: ema.Europa.eu/Find medisin / Human Medicine / Sjeldne sykdomsbetegnelser. Sist oppdatert av denne sammendraget: 01-2015.