Hva er Tracleer?
Tracleer er et legemiddel som inneholder den aktive substansen bosentan. Det er tilgjengelig som oransje og hvite "filmdrasjerte" tabletter (runde: 62, 5 mg, oval: 125 mg) og som blekgul kløverformet tabletter (32 mg) i form av en kløver.
Hva brukes Tracleer til?
Tracleer brukes til å behandle pasienter med pulmonal arteriell hypertensjon (PAH) i klasse III for å forbedre treningskapasiteten (evne til å utøve fysisk aktivitet) og symptomer. PAH er den patologiske tilstanden der trykket i lungearteriene er høyt. "Klassen" reflekterer alvorlighetsgraden av sykdommen: "klasse III" innebærer en sterk begrensning av fysisk aktivitet. PAH kan være:
- primær (uten en identifisert eller familieårsak);
- forårsaket av sklerodermi (også kalt systemisk sklerose, en tilstand preget av unormal vekst av bindevev som støtter huden og andre organer);
- forårsaket av medfødt hjertefeil (fra fødsel) med skudd (unormale forbindelser) som forårsaker en unormal blodstrøm mellom hjertet og lungene.
Noen forbedringer har blitt funnet hos pasienter med PAH i klasse II. "Klasse II" innebærer en liten begrensning av fysisk aktivitet.
Tracleer kan også brukes hos voksne med systemisk sklerose, hvor den dårlige blodsirkulasjonen forårsaket av sykdommen har forårsaket utviklingen av "digitale sår" (betennelse i fingre og tær). Formålet med Tracleer er å redusere antall nye digitale sår.
Gitt det begrensede antall pasienter med PAH og systemisk sklerose, anses disse sykdommene som "sjeldne" og Tracleer ble utpekt som "sjeldne legemidler" (et legemiddel som brukes i sjeldne sykdommer) 14. februar 2001 og 17. mars 2003.
Legemidlet kan kun fås på resept .
Hvordan brukes Tracleer?
Behandling med Tracleer bør startes og overvåkes av en lege som har erfaring med behandling av PAH eller systemisk sklerose.
Tracleer gis om morgenen og om kvelden, i tom mage eller med full mage. Hos voksne bør behandlingen påbegynnes i en dose på 62, 5 mg to ganger daglig i fire uker, og deretter økes til den vanlige dosen på 125 mg to ganger daglig. Hos barn med PAH skal dosen som skal brukes beregnes ut fra kroppsvekt og starter vanligvis med 2 mg per kilo to ganger daglig.
Pasientene må svelge de filmdrasjerte tabletter sammen med vann. Dispersible tabletter skal bare brukes til pasienter som ikke kan ta filmdrasjerte tabletter. De bør oppløses i litt vann i en skje før de tas. Dispersible tabletter har snitt som gjør at de enkelt kan deles inn i fire deler, hver inneholdende 8 mg bosentan. For ytterligere detaljer, se pakningsvedlegget.
Legen vil evaluere pasientens respons på Tracleer og vurdere behovet for å fortsette med videre behandling etter åtte uker hos pasienter med PAH som ikke har rapportert forbedringer så vel som regelmessig hos pasienter med systemisk sklerose og pågående digitale sår.
Pasienter behandlet med Tracleer må gis et spesielt memorandum som oppsummerer hovedinformasjonen om sikkerheten til medisinen.
Hvordan jobber Tracleer?
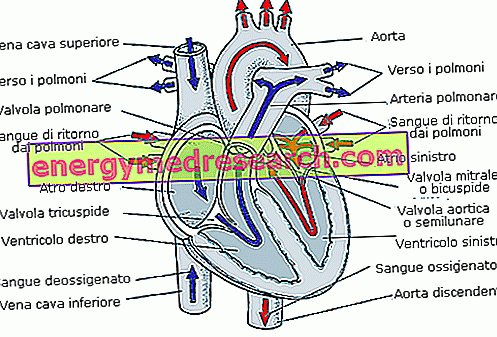
Det aktive stoffet i Tracleer, bosentan, hemmer et naturlig forekommende hormon som kalles endothelin-1 (ET-1), noe som fører til at blodkarene blir redusert. Derfor forårsaker Tracleer en utvidelse av blodårene.
PAH er en svekkende sykdom der en alvorlig innsnevring av blodårene i lungene oppstår. Det forårsaker svært høyt blodtrykk i karene som bærer blod fra høyre side av hjertet til lungene. Dette trykket reduserer mengden oksygen som blodet kan bære inn i lungene, noe som gjør fysisk aktivitet vanskeligere. Ved å utvide disse blodkarene, blir blodtrykket redusert og symptomene forbedres.
Ved pasienter med systemisk sklerose og pågående digitale sår, forbedrer bosentan blodsirkulasjonen i fingre og tær, og forhindrer utviklingen av nye digitale sår.
Hvordan har Tracleer blitt studert?
I PAH ble Tracleer filmdrasjerte tabletter undersøkt i fire hovedstudier: To studier involvert totalt 245 voksne med klasse III eller IV sykdom, som var primær eller forårsaket av sklerodermi, en studie på 54 voksne med Klasse III PAH assosiert med medfødt hjertemangel og en studie av 185 klasse II-sykdomspatienter. Studiene sammenlignet Tracleer med placebo (en dummybehandling), begge ble lagt til standardbehandling. Hovedmålet for effektivitet var avstanden til at pasientene kunne reise til fots på seks minutter (en måte å måle treningsevne på), men studien relatert til sykdom i klasse II observert også variasjonen i resistens til blodstrømmen i lungene i blodkarene (en indikator på innsnevring av beholderen). En studie ble også utført med filmdrasjerte tabletter på 19 barn i alderen mellom tre og 15 år. En videre studie undersøkte effektene av Tracleer dispergerbare tabletter på 36 barn med PAH og i alderen mellom to og 11 år.
I tilfelle av systemisk sklerose med digitale sår, sammenlignet to studier Tracleer filmdrasjerte tabletter med placebo som involverer totalt 312 voksne. Hovedmålet for effektivitet var basert på antall nye digitale sår som utviklet seg under studiene. En av studiene har også sett på virkningen av Tracleer på helbredelse hos 190 pasienter, og måler tiden som trengs for å oppnå fullstendig gjenoppretting av et bestemt digitalt sår valgt hos hver pasient.
Hvilken fordel har Tracleer vist i studiene?
I PAH klasse III eller IV, som var primær eller forårsaket av sklerodermi, viste de to studiene at pasienter behandlet med Tracleer kunne gå lenger enn pasienter behandlet med placebo etter 16 uker (44 meter mer i større studie), men det var for få pasienter med klasse IV sykdom for å bekrefte bruk av stoffet i denne gruppen. Lignende resultater har blitt observert hos pasienter med medfødt hjertefeil.
Hos pasienter med klasse II-sykdom, reduserte Tracleer blodkarresistens med 23% sammenlignet med placebo etter seks måneders behandling, men avstandspasientene kunne gå om seks minutter var lik i de to gruppene.
Forbedringer ble også funnet i studien av barn som tok filmdrasjerte tabletter. I den spredbare tablettstudien var bosentannivåene lavere enn forventet sammenlignet med resultatene fra andre studier og kunne ikke økes med en høyere dose Tracleer. PAH syntes imidlertid å forbli stabil i nesten alle barn over 12 ukers behandling, og i de fleste barn forblev PAH stabilt i minst 18 måneder.
I systemisk sklerose med digitale sår var Tracleer mer effektivt for å redusere utviklingen av nye digitale sår enn placebo. I den første studien hadde pasienter som brukte Tracleer i gjennomsnitt 1, 4 nye digitale sår etter 16 uker sammenlignet med 2, 7 hos pasienter som tok placebo. Lignende resultater ble observert i den andre studien etter 24 uker, men Tracleer hadde ingen effekt på helbredelsen av digitale sår.
Hva er risikoen forbundet med Tracleer?
I PAH er de vanligste bivirkningene med Tracleer (sett hos flere enn 1 av 10 pasienter) hodepine og unormale resultater av tester som utføres for å kontrollere leveren. Hos pasienter med digitale sår er de fleste bivirkninger (sett hos mer enn 1 pasient hos 10) unormale leverprøver, ødem (hevelse) og væskeretensjon. Gitt risikoen for å utvikle leverproblemer, må legen måle nivåene av leverenzymer før behandling og hver måned under behandling med Tracleer. For fullstendig liste over alle bivirkninger som er rapportert med Tracleer, se pakningsvedlegget.
Effektiviteten av noen medisiner (for eksempel prevensjonspillen) kan påvirkes av samtidig inntak av Tracleer. For ytterligere detaljer, se pakningsvedlegget.
Tracleer skal ikke brukes til personer som kan være overfølsomme (allergiske) mot bosentan eller noen av de andre innholdsstoffene. Tracleer må ikke brukes til pasienter som har leverproblemer, hos kvinner som er gravide eller sannsynligvis er gravide, eller hos pasienter behandlet med cyklosporin A (et legemiddel som påvirker immunforsvaret).
Hvorfor har Tracleer blitt godkjent?
Utvalget for humanmedisinske preparater (CHMP) har fastslått at fordelene med Tracleer oppveier risikoen ved behandling av PAH-pasienter og ved å redusere antall nye digitale sår hos pasienter med systemisk sklerose og pågående digitale sår . Utvalget anbefalte at Tracleer skal få markedsføringstillatelse.
I utgangspunktet ble Tracleer autorisert i "eksepsjonelle omstendigheter" fordi, da PAH er en sjelden sykdom, var begrenset informasjon tilgjengelig ved første godkjenning. Som det farmasøytiske firmaet ga de ønskede ytterligere opplysninger, ble tilstanden om "eksepsjonelle omstendigheter" fjernet 30. november 2004.
Hvilke tiltak blir tatt for å sikre sikker bruk av Tracleer?
Selskapet som lager Tracleer, vil gi informasjonssett for forskrivere og et informasjonsblad for pasienter i hver medlemsstat, som forklarer sikkerheten til Tracleer (spesielt dets virkninger på leveren og under graviditeten) og deres interaksjoner. Det farmasøytiske selskapet vil også nøye overvåke distribusjonen av medisinen i hver medlemsstat og samle inn opplysninger om bruk i pasienter med systemisk sklerose og pågående digitale sår.
Mer informasjon om Tracleer:
Den 15. mai 2002 ga Europakommisjonen en markedsføringstillatelse gyldig i hele EU til Actelion Registration Ltd. Denne fullmakten ble fornyet 15. mai 2007.
Sammendragene av uttalelsen fra Komiteen for sjeldne legemidler til Tracleer er tilgjengelige her (PAH) og her (systemisk sklerose).
Den fullstendige EPAR for Tracleer finner du her.
Siste oppdatering av denne sammendraget: 05-2009.