Trypsin og chymotrypsin er to sentrale enzymer i fordøyelsen av diettproteiner. Begge er produsert og utskilt som zymogener, dvs. i en inaktiv form ved bukspyttkjertelen; Zymogen-forløperen av trypsin kalles trypsinogen, mens det av chymotrypsin kalles chymotrypsinogen.
Trypsin og chymotrypsin tilhører den store familien av proteolytiske enzymer (involvert i proteinfordøyning) og til endopeptidasegruppen. Disse stoffene - inkludert gastrisk pepsin og bukspyttkjertelastase - angriper peptidbindinger i aminosyrekjeden, noe som gir opphav til mindre molekylære fragmenter. De enzymer som tilhører den andre gruppen, eksopeptidaser, fullfører arbeidet med trypsin og chymotrypsin, fjerner individuelle aminosyrer fra endene av peptidkjeden; Bukspyttkjertelkarboxypeptidaser (A1, A2 og B, som angriper karboksylenden) tilhører denne familien, men også aminopeptidaser (som angriper den aminoterminale enden) og dipeptidaser, både produsert og utskilt av tynntarmens slimhinne. Noen karboxypeptidaser, lik de som er sett for trypsin (trypsinogen) og chymotrypsin (chymotrypsinogen), utskilles av bukspyttkjertelen i en inaktiv form. I alle tre tilfeller er enzymet involvert i den enzymatiske aktiveringsprosessen enteropeptidasen, et protein som produseres og utskilles av cellene i duodenale slemhinnene; Nærmere bestemt er enteropeptidasen spesifikk for trypsinogen, som en gang omdannet til trypsin aktiverer også de andre proteolytiske enzymer, inkludert trypsinogen selv.
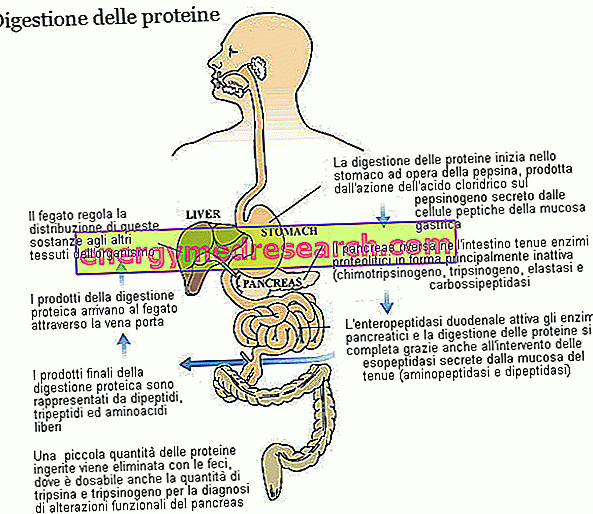
De funksjonelle forskjellene mellom trypsin og chymotrypsin angår bare deres spesifisitet, det er evnen til å gjenkjenne og bryte ned bare bindingene dannet av veldefinerte aminosyrer. Trypsin intervenerer hovedsakelig på peptidbindingene som involverer basiske aminosyrer (som arginin og lysin), mens chymotrypsin hovedsakelig hydroserer bindinger som involverer tyrosin, fenylalanin, tryptofan, leucin og metionin.
Takket være de forskjellige proteolytiske enzymer, med bidrag fra mavesyre, er diettproteiner - opprinnelig dannet av flere titalls aminosyrer - fordelt på dipeptider, tripeptider og frie aminosyrer, alle lett absorberbare stoffer som kommer fra tarmslimhinnens kapillærer transporteres til leveren.
Trypsin og chymotrypsin i avføring
Bestemmelsen av chymotrypsin og trypsin i avføring brukes, og var spesielt så tidligere, som en indirekte test av den eksokrine bukspyttkjernes funksjonelle kapasitet. Hvis noe ikke fungerer riktig på dette kjertelenivået, er det logisk å forvente en redusert syntese av trypsin og chymotrypsin, som også vil være mangelfull i fæces. Testen har god følsomhet, men er belastet av den reelle risikoen for falske positive og falske negativer. Bruk av avføringsmidler, for eksempel, reduserer konsentrasjonen av enzymer i fekalmaterialet, mens inntaket av fordøyelseskanalen i bukspyttkjertelen (som pankreatin) eller grønnsaker (f.eks ananasstengel, papaya, papain og bromelain) forårsaker falske negative resultater. Også den intestinale bakterieflora påvirker litt mengden trypsin og chymotrypsin som kommer uendret i avføringen. Av denne grunn kan bruk av antibiotika gi falske negativer; Tvert imot, i nærvær av divertikulose og andre forhold som favoriserer bakteriell proliferasjon, kan falske positive resultater registreres.
En klassisk anvendelse av trypsin og chymotrypsin dosering i avføring er påvisning av bukspyttkjertelinsuffisiens hos pasienter med cystisk fibrose. En av konsekvensene av denne sykdommen er nedsatt normal transport av trypsin og andre fordøyelsesenzymer fra bukspyttkjertelen til tolvfingertarmen. Av denne grunn, ved fødselen, er feces av barnet med cystisk fibrose spesielt kompakte, til det punktet å forårsake en tarmobstruksjon. Som et resultat blir spesielt små mengder av chymotrypsin og trypsin registrert i mekonium.



